1 Arista™ AH PMA P050038 Clinical Study.
2 Consultez le mode d’emploi intégral pour obtenir les directives d’application détaillées.
3 Mode d’emploi d’Arista™ AH.
INDICATIONS
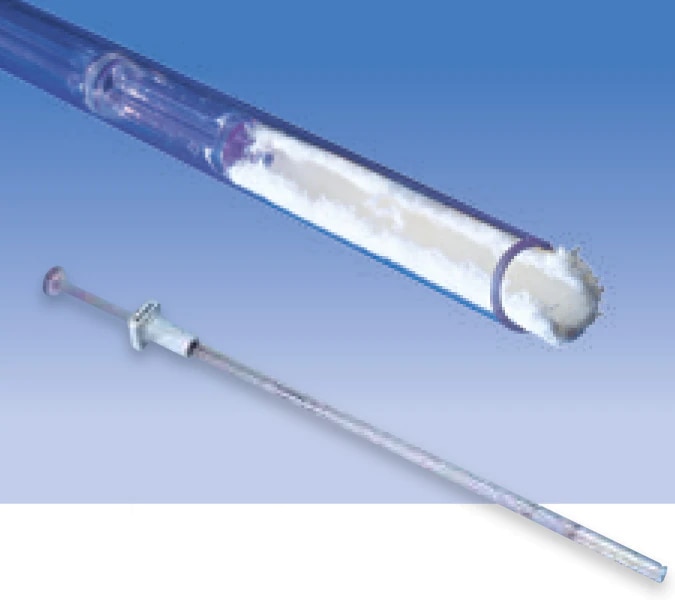
L’utilisation d’Arista™ AH est indiquée au cours d’interventions chirurgicales (sauf les interventions neurologiques et ophtalmiques) en tant que dispositif hémostatique d’appoint pour assister au contrôle des saignements capillaires, veineux et artériolaires en supplément de la pression, de la ligature et de tout autre moyen conventionnel si ceux-ci s’avèrent inefficaces ou non praticables.
CONTRE-INDICATIONS
Ne pas injecter ou appliquer d’Arista™ AH dans les vaisseaux sanguins; sa présence entraîne un risque d’embolie pouvant causer la mort.
AVERTISSEMENTS
L’Arista™ AH n’a pas été conçu pour se substituer à une technique chirurgicale méticuleuse ni à l’application adéquate de ligatures ou d’autres méthodes conventionnelles d’hémostase.
Une fois l’hémostase atteinte, l’excès d’Arista™ AH doit être éliminé du site d’application par irrigation et aspiration, surtout si le produit est utilisé près des foramens osseux et des zones à proximité des os, de la moelle épinière, du nerf optique et/ou du chiasma optique.L’Arista™ AH gonfle pour atteindre son volume maximal dès son contact avec le sang ou tout autre liquide. Tout volume d’Arista™ AH sec et blanc doit être éliminé. La possibilité d’interférence du produit avec une fonction normale ou d’apparition d’une nécrose de compression des tissus environnants due au gonflement est réduite par l’élimination du matériel sec en excès.
La sécurité et l’efficacité cliniques de l’Arista™ AH n’ont pas été testées chez les enfants et les femmes enceintes. Les données montrent que les nouveaux-nés et les bébés de moins de 10 mois peuvent présenter une activité inférieure des amylases; le taux de résorption d’Arista™ AH dans cette population pourrait donc excéder 48 heures..
L’utilisation d’Arista™ AH en présence d’une infection ou sur une zone corporelle contaminée doit se faire avec précaution. Une nouvelle chirurgie pourrait être nécessaire en présence de signes d’infection ou de développement d’un abcès au site d’application d’Arista™ AH afin de permettre le drainage.
La sécurité et l’efficacité du produit dans le cadre d’interventions neurochirurgicales et ophtalmiques n’ont pas été déterminées.
L’Arista™ AH ne doit pas servir au contrôle des saignements après un accouchement ou des ménorragies.
PRÉCAUTIONS
Lorsque l’Arista™ AH est utilisé conjointement avec des circuits de récupération de sang autologue, suivre attentivement les directives données dans la section Administration du mode d’emploi concernant l’exécution d’une filtration appropriée et d’un lavage cellulaire.
L’Arista™ AH a été conçu pour être utilisé à l’état sec. Un contact préalable à l’application et à l’atteinte de l’hémostase avec une solution saline ou antibiotique entraînera une perte de potentiel hémostatique.
L’utilisation de l’Arista™ AH n’est pas recommandée pour le traitement primaire des troubles de la coagulation.
Aucun essai n’a été exécuté pour vérifier l’utilisation d’Arista™ AH sur les surfaces osseuses sur lesquelles du matériel prothétique doit être fixé avec un adhésif; une telle utilisation n’est donc pas recommandée.
L’Arista™ AH est livré stérile et ne peut pas être restérilisé. Tout contenant d’Arista™ AH ouvert et inutilisé doit être éliminé.
Ne pas appliquer une quantité d’Arista™ AH excédant 50 g chez un patient diabétique; il a été calculé qu’une quantité excédant 50 g pouvait avoir un impact sur la charge glycémique.
Dans le cadre d’une intervention urologique, l’Arista™ AH ne doit pas être laissé dans le bassinet ni dans l’uretère afin d’éviter tout foyer potentiel de formation de calculs.
RÉACTIONS INDÉSIRABLES
Aucun des événements indésirables survenus au cours d’un essai clinique prospectif randomisé à contrôle concurrent n’a été jugé comme étant lié à l’usage de l’Arista™ AH par le comité de surveillance de la sécurité des données. Les événements indésirables les plus fréquents se sont avérés être des douleurs liées à la chirurgie, une anémie, des nausées, des valeurs d’analyses de laboratoire hors des plages normales, de l’arythmie, de la constipation, de la défaillance respiratoire et de l’hypotension. Tous ces événements ont été rapportés dans une proportion supérieure à 10 % des patients traités avec l’Arista™ AH. Les détails des événements indésirables survenus au cours de cet essai clinique peuvent être consultés dans le mode d’emploi accompagnant le produit; ils sont également disponibles au www.bd.com.
Mise en garde : La loi fédérale (des États-Unis) restreint la vente de ce dispositif par ou sur ordonnance d’un médecin agréé ou d’un praticien dûment agréé.
BD-14602