-
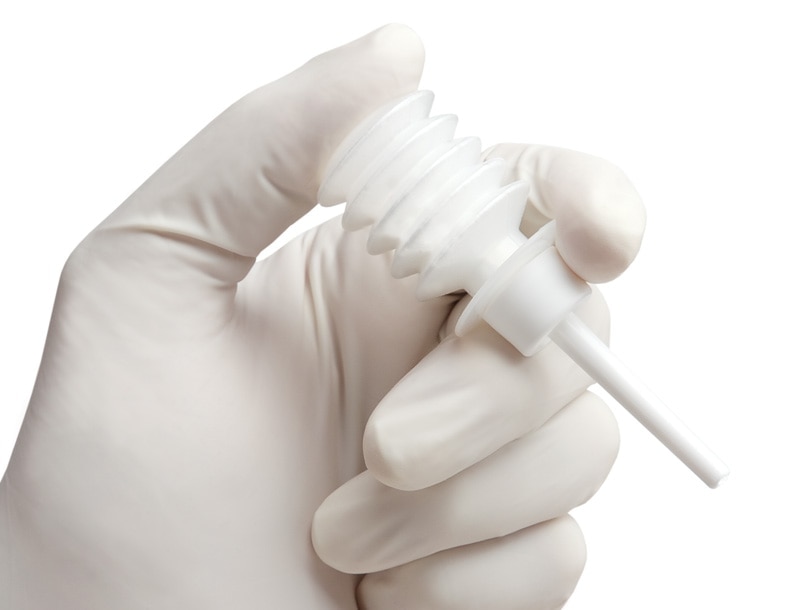
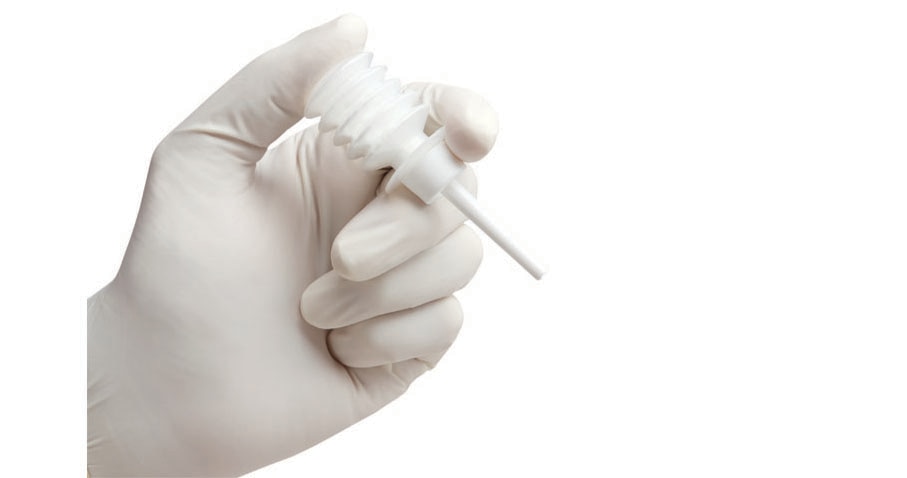
Arista™ AH FlexiTip™ XL Applicator, 38 cm, 5 per Case
SKU/REF am0005
-
Arista™ AH FlexiTip™ Applicator, 14 cm (includes two applicators), 5 per Case
Includes two applicators
SKU/REF am0004
true

- Présentation
- Principales caractéristiques
- Produits et accessoires
- Mode d’emploi en version électronique et ressources
- FAQ
Simple. Sûr. Efficace.
Arista™ AH est une poudre hémostatique chirurgicale absorbable d’origine végétale à 100 % dérivée d’amidon végétal purifié. La puissance d’Arista™ AH repose sur ses hémosphères polysaccharidiques microporeuses, une technologie brevetée de coagulation sanguine.
L’utilisation d’Arista™ AH est indiquée au cours d’interventions chirurgicales (sauf les interventions neurologiques et ophtalmiques) en tant que dispositif hémostatique d’appoint pour aider au contrôle des saignements capillaires, veineux et artériolaires en supplément de la pression, de la ligature et de tout autre moyen conventionnel si ceux-ci s’avèrent inefficaces ou non praticables.
SIMPLE
- Aucun mélange ni aucune réfrigération nécessaires
- Prêt sur demande, avec une durée de conservation de cinq ans
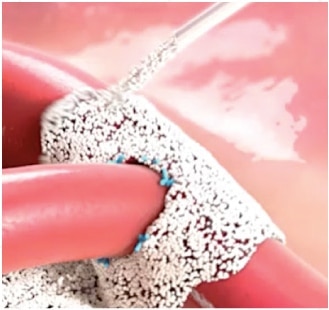
- Retirez le bouchon et appliquez la poudre directement sur le point de saignement2
SÛR
- Sans thrombine, biocompatible et apyrogène
- Normalement absorbé et éliminé sous 24 à 48 heures* par les amylases
* Les données montrent que les nouveau-nés jusqu’aux bébés âgés de moins de 10 mois peuvent présenter une réduction de l’activité des amylases; les taux de résorption d’Arista™ AH au sein de cette population pourraient donc excéder 48 heures.
Technologie exclusive MPH™ : une approche unique d’atteinte de l’hémostase
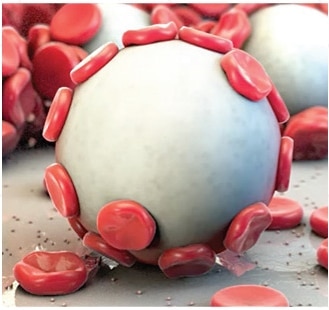
La puissance d’Arista™ AH repose sur sa technologie MPH™ (hémosphères polysaccharidiques microporeuses) exclusive. Les sphères, composées de particules microporeuses dont la taille des pores est contrôlée, sont conçues pour faire effet de tamis moléculaire. L’action osmotique puissante déshydrate et gélifie le sang au contact afin d’accélérer le processus de coagulation naturel.

EFFICACE
- Le processus de coagulation débute au contact, quel que soit le statut de coagulation du patient3
- Atteinte de l’hémostase complète en quelques minutes seulement1
- Assure une grande couverture sur les surfaces inégales et les zones difficiles à atteindre
1 Étude clinique Arista™ AH PMA P050038.
2 Consultez le mode d’emploi intégral pour obtenir les directives d’application détaillées.
3 Mode d’emploi d’Arista™ AH.
INDICATIONS
L’utilisation d’Arista™ AH est indiquée au cours d’interventions chirurgicales (sauf les interventions neurologiques et ophtalmiques) en tant que dispositif hémostatique d’appoint pour assister au contrôle des saignements capillaires, veineux et artériolaires en supplément de la pression, de la ligature et de tout autre moyen conventionnel si ceux-ci s’avèrent inefficaces ou non praticables.
CONTRE-INDICATIONS
N’injectez ou n’appliquez pas d’Arista™ AH dans les vaisseaux sanguins; sa présence représente un risque d’embolie pouvant causer la mort.
AVERTISSEMENTS
L’Arista™ AH n’a pas été conçu pour se substituer à une technique chirurgicale méticuleuse ni à l’application adéquate de ligatures ou d’autres méthodes conventionnelles d’hémostase.
Une fois l’hémostase atteinte, l’excès d’Arista™ AH doit être éliminé du site d’application par irrigation et aspiration, surtout si le produit est utilisé près des foramens osseux et des zones à proximité des os, de la moelle épinière ou du nerf optique et du chiasma optique.L’Arista™ AH gonfle pour atteindre son volume maximal dès son contact avec le sang ou tout autre liquide. Tout Arista™ AH sec et blanc doit être éliminé. La possibilité d’interférence du produit avec une fonction normale ou d’apparition d’une nécrose de compression des tissus environnants due au gonflement est réduite par l’élimination de l’excès de matières sèches.
L’innocuité et l’efficacité cliniques de l’Arista™ AH n’ont pas été testées chez les enfants et les femmes enceintes. Les données montrent que les nouveau-nés jusqu’aux bébés âgés de moins de 10 mois peuvent présenter une réduction de l’activité des amylases; les taux de résorption d’Arista™ AH au sein de cette population pourraient donc excéder 48 heures.
L’utilisation d’Arista™ AH en présence d’une infection ou sur une zone corporelle contaminée doit se faire avec précaution. Une nouvelle chirurgie pourrait être nécessaire en présence de signes d’infection ou de développement d’un abcès au site d’application d’Arista™ AH afin de permettre le drainage.
L’innocuité et l’efficacité du produit dans le cadre d’interventions neurochirurgicales et ophtalmiques n’ont pas été déterminées.
L’Arista™ AH ne doit pas servir au contrôle des saignements après un accouchement ou des ménorragies.
PRÉCAUTIONS
Lorsque l’Arista™ AH est utilisé conjointement avec des circuits de récupération de sang autologue, suivez attentivement les directives données dans la section Administration du mode d’emploi concernant l’exécution d’une filtration appropriée et d’un lavage cellulaire.
L’Arista™ AH a été conçu pour être utilisé à l’état sec. Un contact préalable à l’application et à l’atteinte de l’hémostase avec une solution saline ou antibiotique entraînera une perte de potentiel hémostatique.
L’utilisation d’Arista™ AH n’est pas recommandée pour le traitement primaire des troubles de la coagulation.
Aucun essai n’a été réalisé pour vérifier l’utilisation d’Arista™ AH sur les surfaces osseuses sur lesquelles des matières prothétiques doivent être fixées avec un adhésif; une telle utilisation n’est donc pas recommandée.
L’Arista™ AH est livré stérile et ne peut pas être stérilisé à nouveau. Tout contenant d’Arista™ AH ouvert et inutilisé doit être éliminé.
N’appliquez pas d’Arista™ AH en quantités excédant 50 g chez un patient diabétique; il a été calculé qu’une quantité excédant 50 g pourrait avoir un impact sur la charge glycémique.
L’Arista™ AH ne doit pas être laissé dans le bassin rénal ni dans les uretères lors des interventions urologiques visant l’élimination des foyers potentiels de formation de calculs.
RÉACTIONS INDÉSIRABLES
Aucun des événements indésirables survenus au cours d’un essai clinique prospectif randomisé à contrôle concurrent n’a été jugé comme étant lié à l’usage de l’Arista™ AH par le comité de surveillance de la sécurité des données. Les événements indésirables les plus fréquents se sont avérés être des douleurs liées à la chirurgie, une anémie, des nausées, des valeurs d’analyses de laboratoire hors des plages normales, de l’arythmie, de la constipation, de la défaillance respiratoire et de l’hypotension. Tous ces événements ont été signalés dans une proportion supérieure à 10 % chez les patients traités avec l’Arista™ AH. Les détails des événements indésirables survenus au cours de cet essai clinique peuvent être consultés dans le mode d’emploi accompagnant le produit; ils sont également disponibles sur le site www.bd.com.
Mise en garde : La loi fédérale (des États-Unis) restreint la vente de ce dispositif par ou sur ordonnance d’un médecin agréé ou d’un praticien dûment agréé.
BD-14602
Que sont les agents hémostatiques absorbables et comment fonctionnent-ils?
Qu’est-ce qu’un agent hémostatique absorbable?
Les agents hémostatiques absorbables sont utiles en tant que traitement d’appoint pendant les interventions chirurgicales lorsque les méthodes classiques ne contrôlent pas le saignement chirurgical. 1

Les agents hémostatiques et leur utilisation
Les agents hémostatiques sont des substances contribuant à prévenir/arrêter les saignements du site hémorragique et impliquent les réactions dépendantes des protéines plasmatiques, des ions de calcium et des plaquettes sanguines, ce qui ramollit le bouchon plaquettaire de la conversion de fibrinogène en fibrine.
1 Étude clinique Arista™ AH PMA P050038.
2 Consultez le mode d’emploi intégral pour obtenir les directives d’application détaillées.
3 Mode d’emploi d’Arista™ AH.
INDICATIONS
L’utilisation d’Arista™ AH est indiquée au cours d’interventions chirurgicales (sauf les interventions neurologiques et ophtalmiques) en tant que dispositif hémostatique d’appoint pour assister au contrôle des saignements capillaires, veineux et artériolaires en supplément de la pression, de la ligature et de tout autre moyen conventionnel si ceux-ci s’avèrent inefficaces ou non praticables.
CONTRE-INDICATIONS
N’injectez ou n’appliquez pas d’Arista™ AH dans les vaisseaux sanguins; sa présence représente un risque d’embolie pouvant causer la mort.
AVERTISSEMENTS
L’Arista™ AH n’a pas été conçu pour se substituer à une technique chirurgicale méticuleuse ni à l’application adéquate de ligatures ou d’autres méthodes conventionnelles d’hémostase.
Une fois l’hémostase atteinte, l’excès d’Arista™ AH doit être éliminé du site d’application par irrigation et aspiration, surtout si le produit est utilisé près des foramens osseux et des zones à proximité des os, de la moelle épinière ou du nerf optique et du chiasma optique.L’Arista™ AH gonfle pour atteindre son volume maximal dès son contact avec le sang ou tout autre liquide. Tout Arista™ AH sec et blanc doit être éliminé. La possibilité d’interférence du produit avec une fonction normale ou d’apparition d’une nécrose de compression des tissus environnants due au gonflement est réduite par l’élimination de l’excès de matières sèches.
L’innocuité et l’efficacité cliniques de l’Arista™ AH n’ont pas été testées chez les enfants et les femmes enceintes. Les données montrent que les nouveau-nés jusqu’aux bébés âgés de moins de 10 mois peuvent présenter une réduction de l’activité des amylases; les taux de résorption d’Arista™ AH au sein de cette population pourraient donc excéder 48 heures.
L’utilisation d’Arista™ AH en présence d’une infection ou sur une zone corporelle contaminée doit se faire avec précaution. Une nouvelle chirurgie pourrait être nécessaire en présence de signes d’infection ou de développement d’un abcès au site d’application d’Arista™ AH afin de permettre le drainage.
L’innocuité et l’efficacité du produit dans le cadre d’interventions neurochirurgicales et ophtalmiques n’ont pas été déterminées.
L’Arista™ AH ne doit pas servir au contrôle des saignements après un accouchement ou des ménorragies.
PRÉCAUTIONS
Lorsque l’Arista™ AH est utilisé conjointement avec des circuits de récupération de sang autologue, suivez attentivement les directives données dans la section Administration du mode d’emploi concernant l’exécution d’une filtration appropriée et d’un lavage cellulaire.
L’Arista™ AH a été conçu pour être utilisé à l’état sec. Un contact préalable à l’application et à l’atteinte de l’hémostase avec une solution saline ou antibiotique entraînera une perte de potentiel hémostatique.
L’utilisation d’Arista™ AH n’est pas recommandée pour le traitement primaire des troubles de la coagulation.
Aucun essai n’a été réalisé pour vérifier l’utilisation d’Arista™ AH sur les surfaces osseuses sur lesquelles des matières prothétiques doivent être fixées avec un adhésif; une telle utilisation n’est donc pas recommandée.
L’Arista™ AH est livré stérile et ne peut pas être stérilisé à nouveau. Tout contenant d’Arista™ AH ouvert et inutilisé doit être éliminé.
N’appliquez pas d’Arista™ AH en quantités excédant 50 g chez un patient diabétique; il a été calculé qu’une quantité excédant 50 g pourrait avoir un impact sur la charge glycémique.
L’Arista™ AH ne doit pas être laissé dans le bassin rénal ni dans les uretères lors des interventions urologiques visant l’élimination des foyers potentiels de formation de calculs.
RÉACTIONS INDÉSIRABLES
Aucun des événements indésirables survenus au cours d’un essai clinique prospectif randomisé à contrôle concurrent n’a été jugé comme étant lié à l’usage de l’Arista™ AH par le comité de surveillance de la sécurité des données. Les événements indésirables les plus fréquents se sont avérés être des douleurs liées à la chirurgie, une anémie, des nausées, des valeurs d’analyses de laboratoire hors des plages normales, de l’arythmie, de la constipation, de la défaillance respiratoire et de l’hypotension. Tous ces événements ont été signalés dans une proportion supérieure à 10 % chez les patients traités avec l’Arista™ AH. Les détails des événements indésirables survenus au cours de cet essai clinique peuvent être consultés dans le mode d’emploi accompagnant le produit; ils sont également disponibles sur le site www.bd.com.
Mise en garde : La loi fédérale (des États-Unis) restreint la vente de ce dispositif par ou sur ordonnance d’un médecin agréé ou d’un praticien dûment agréé.
BD-14602
-

Les agents hémostatiques BD se présentent sous des formes diverses utilisables dans une multitude d’applications chirurgicales. Ils sont tous destinés à accélérer le processus naturel de coagulation. Ils sont aisément utilisables avec les applicateurs préchargés et les produits prêts à l’emploi.
-
Nous proposons une gamme complète de produits chirurgicaux
Littérature
Le corpus de publications de BD sur le secteur et nos offres vous donne des informations que vous pouvez utiliser pour continuer à viser l’excellence.
En savoir plus
Formation
BD met à votre disposition des ressources de formation pour vous aider à améliorer vos pratiques cliniques, dans le cadre de notre objectif « faire progresser le monde de la santé ».
En savoir plus
Événements
BD soutient le secteur des soins de santé en proposant des produits et des services de pointe pour améliorer les soins tout en diminuant les coûts. Nous organisons des événements et participons à des rencontres qui excellent à « faire progresser le monde de la santé™ ».
En savoir plus
Études de cas
BD promeut l’excellence clinique en fournissant diverses ressources sur les bonnes pratiques, les innovations cliniques et les tendances au sein du secteur de la santé.
En savoir plus
The Basics of Arista™ AH Absorbable Hemostatic Particles
- Topical hemostats include agents that act as a mechanical barrier to bleeding and provide a physical matrix for clotting, biologically active agents that catalyze coagulation, and combination therapies. 2
- Hemostats can enhance clot formation and wound healing, and can be useful for controlling or preventing troublesome bleeding during surgical interventions where conventional methods of hemostasis are inadequate.2
- AH is an absorbable powdered hemostatic agent intended for application to surgical wound sites to control bleeding. It is a fine, dry, sterilized white powder that is biocompatible, non-pyrogenic, and typically absorbed within 24-48 hours."
- Arista™ AH is a 100% plant based absorbable surgical hemostatic powder derived from purified plant starch. The power of Arista™ AH lies in its Microporous Polysaccharide Hemospheres, a patented blood clotting technology. Consisting of microporous particles with a controlled pore size, the spheres are designed to act as a molecular sieve. The powerful osmotic action dehydrates and gels the blood on contact to accelerate the natural clotting process."
How Arista™ AH Works & Is Used
- The acronym “RAPID” can be used to remember the application steps:
- R (Remove): Remove all access blood
- A (Apply): Apply AristaTM AH liberally to the bleeding site
- P (Pressure): Administer wound-appropriate pressure until hemostasis is achieved
- I (Irrigate): Irrigate and remove excess Arista™ AH from the site
- D (Done): Hemostasis Hemostasis achieved— quickly, safely and effectively
- With the FlexiTip™ spray applicator, applying Arista™ AH accurately and directly is fast and simple. The delivery system features a lightweight, plastic device with a long, flexible tube. The FlexiTip™ and FlexiTip™ XL extended reach applicator tips provide the precise and accurate delivery of Arista™ AH hemostatic powder from a simple, single-use device.1
- Arista Application: see instructions for use 1
- Directions for Use:
- Blot, wipe, or suction the bleeding tissue. It is important to remove excess blood so Arista™ AH may be applied immediately and directly to the site of active bleeding.
- Position the applicator tip as close to the source of bleeding as possible. Immediately apply a liberal amount of Arista™ AH at the site of bleeding within the wound, to completely cover the wound. Deep wounds may require equally deep application of Arista™ AH. To minimize occlusion of the tip, pressure should be applied to deliver Arista™ AH as the applicator enters the wound
- Quickly apply wound-appropriate, direct pressure over the treated site. Use of a non-adhering substrate to apply pressure may prevent adhesion of the formed clot to the surgical glove or other instrumentation. Amount and duration of pressure is wound dependent. For oozing, pressure may not be necessary. For more profusely bleeding wounds, pressure should be maintained longer.
- If bleeding or oozing continues, remove excess Arista™ AH and reapply.
- If any material other than the clot-bound Arista™ AH (i.e. surgical dressing) adheres to the wound site, irrigate the material with saline and carefully remove it from the treated site.
- Immediately upon contact with blood or fluid, Arista™ AH will swell to approximately 5 times its original volume. Once hemostasis is achieved, excess Arista™ AH should be carefully removed by irrigation and aspiration. Avoid irrigation of direct suction of the formed blood clot.1
- Administration: A liberal amount of Arista™ AH should be applied to the bleeding site (see DIRECTIONS FOR USE) followed by pressure until hemostasis is achieved. After hemostasis is achieved, Arista™ AH should be removed by irrigation and/or aspiration.1
Examples of surgeries that Arista™ AH can be used in include:
- Cardiothoracic and cardiovascular
- Vascular
- Gynecological
- Urology
- Orthopedic surgery
- General surgery
- Plastic surgery
- Ear
- nose
- throat (ENT) surgery
Advantages of Arista™ AH
- A wide variety of topical hemostats are approved as adjunctive therapies in the maintenance of hemostasis during surgical procedures in which conventional methods are insufficient or not practical.2
- Potential cost benefits in terms of preventing the further utilization of hospital resources to manage surgical bleeding. In addition to other patient blood management strategies, the intraoperative use of topical hemostats may reduce the need for transfusion of blood products (e.g., packed red blood cells, platelets, fresh frozen plasma) and reduce the duration of postoperative care (length of hospital stay) each of which is associated with substantial costs.2
Simple to Use
- Ready on demand
- Simply pop the cap and apply the powder directly to the bleeding site
- No mixing and no refrigeration
- Five-year shelf life4
Safe and Thrombin-Free
- Synthesized from a purified plant starch
- Thrombin-free, biocompatible and nonpyrogenic
- Typically absorbed and cleared within 24–48 hours by amylases
- Arista™ AH is the only currently available hemostat that is approved for cell salvage compatibility1,6,7
Effective Hemostat
- The clotting process begins on contact, regardless of patient’s coagulation status
- Complete hemostasis can be achieved in minutes5
- Provides broad area coverage
Arista™ AH Results and Case Studies
PMA clinical trial (General, Orthopedic, Cardiac)
Cardiac & Vascular:
- Bruckner et al. (2014) Microporous polysaccharide hemosphere absorbable hemostat use in cardiothoracic surgical procedures
- Reynbakh et al. (2018) Use of MPH hemostatic powder for electrophysiology device implantation reduces postoperative rates of pocket hematoma and infection
- Bruckner and Loebe (2012a) Microporous polysaccharide hemosphere absorbable hemostat (AristaAH) use in re-operative cardiac surgical procedures.
- Bruckner and Loebe (2012b) The use of an absorbable microporous polysaccharide hemosphere haemostat (AristaAH) in ventricular assist device implant and cardiac transplantation procedures.
- Benlier et al. (2007) Microvascular anastomosis with minimal suture and arista: An experimental study
ENT:
- Antisdel et al. (2011) Microporous polysaccharide hemospheres do not increase synechiae after sinus surgery: Randomized controlled study
- Antisdel et al. (2009a) Effect of hemostatic Agent MPH on bleeding after endoscopic sinus surgery: A prospective randomized controlled study
- Antisdel et al. (2016) Product comparison model in otolaryngology: Equivalency analysis of absorbable hemostatic agents after endoscopic sinus surgery
- Phillips (2013) Safety and efficacy of Arista powder in 514 nasal septal and sinus surgery patients
- Sindwani (2009) Use of novel hemostatic powder MPH for endoscopic sinus surgery: Initial impressions
- Antisdel et al. (2008) Hemostatic agent Microporous Polysaccharide Hemospheres (MPH) does not affect healing or intact sinus mucosa
General:
- Egeli et al. (2012) Microporous polysaccharide hemospheres and seroma formation after mastectomy and axillary dissection in rats
- Humphreys et al. (2008a) Microporous polysaccharide hemospheres for management of laparoscopic trocar injury to the spleen
- Humphreys et al. (2008b) Renal injury and the application of polysaccharide hemospheres: A laparoscopic experimental model
- Hoffmann et al. (2009) Choice of Hemostatic Agent Influences Adhesion Formation in a Rat Cecal Adhesion Mode
- Ereth et al. (2009) Microporous polysaccharide hemospheres do not enhance abdominal infection in a rat model compared with gelatin matrix
Urology
- Nunez-Nateras et al. (2013) Athermal nerve sparing robot-assisted radical prostatectomy: Initial experience with microporous polysaccharide hemospheres as a topical hemostatic agent
- Gilbert et al. (2016) Evaluation of Absorbable Hemostatic Powder for Prevention of Lymphoceles Following Robotic Prostatectomy With Lymphadenectomy
- Murat et al. (2006) Evaluation of microporous polysaccharide hemospheres for parenchymal hemostasis during laparoscopic partial nephrectomy in the porcine model
- Arista™ AH IFU
- Gabay, M. & Boucher, B.A. An essential primer for understanding the role of topical hemostats, surgical sealants, and adhesives for maintaining hemostasis. Pharmacotherapy 33, 935-955 (2013).
- Safety and effectiveness of ARISTA™ AH have not been clinically evaluated in children and pregnant women. Because there have been reports of decreased amylase activity in newborns up to 10 months, absorption rates of ARISTA™ AH in this population may be longer than 48 hours
- Data on file
- ARISTA™ AH PMA Clinical Study P050038
- BD Data on file. Preclinical data may not correlate to clinical performance in humans.
- When Arista™ AH is used in conjunction with autologous blood salvage circuits, a 40 μ cardiotomy reservoir, cell washing, and 40 μ transfusion filter must be used.
BD-53859
true
true
